O uso industrial de enzimas vem ganhando cada vez mais destaque. Podemos citar também as enzimas especiais, as quais são amplamente empregadas na terapêutica, diagnóstico e imunoensaios. Devido à sua natureza proteica, uma grande parcela das enzimas apresenta grande instabilidade em determinadas condições reacionais. Uma excelente forma de estabilizá-las é o emprego de técnicas de imobilização.
É de grande interesse o aumento e a manutenção da estabilidade de enzimas, bem como a reutilização destas proteínas em vários processos, uma vez que a sua produção (ou extração) e purificação, na maioria das vezes, é um processo bastante custoso e demorado. Dessa forma, a imobilização utilizando técnicas e suportes diversos tem se tornado uma estratégia para garantir a estabilidade e o reuso desses biocatalisadores.
Métodos de imobilização
As enzimas podem ser imobilizadas por dois métodos principais, classificados em: aprisionamento e formação de ligação.
Dentre as técnicas de aprisionamento temos:
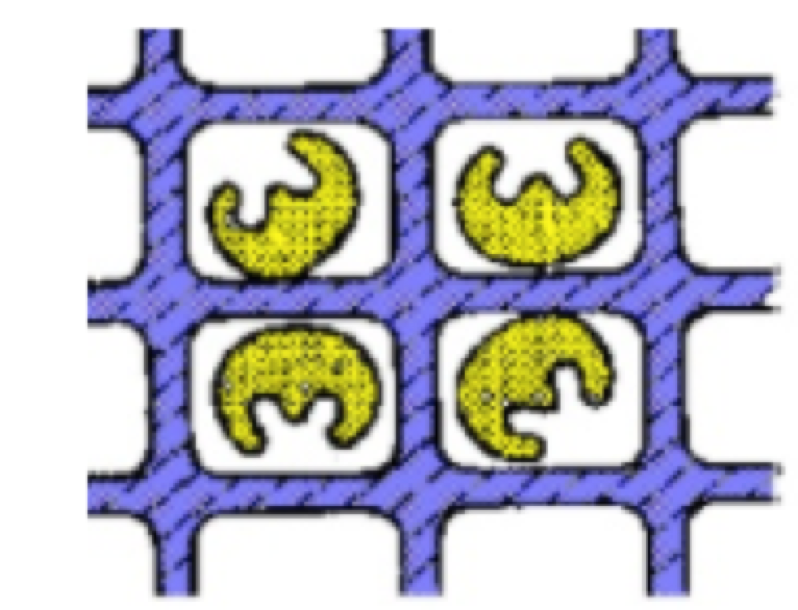
* Enredamento: a enzima é imobilizada dentro de uma malha polimérica. A proteína é adicionada a uma solução contendo a unidade monomérica do polímero, e então esta solução é polimerizada, mantendo-a presa em uma matriz solidificada. Um exemplo é a imobilização em gel de poliacrilamida. Este suporte é obtido por meio da reação entre a acrilamida e a N, N-metileno-bis(acrilamida). É de fácil execução e adequada para muitas enzimas.
Esquema de Enredamento da enzima em uma matriz polimérica. A matriz está representada em azul e a enzima em amarelo.
* Encapsulamento: Este método imobiliza a enzima em cápsulas. A utilização do polissacarídeo alginato como suporte é uma das formas mais comuns de encapsulamento. A imobilização de enzimas em alginato ocorre de forma muito simples, apenas gotejando uma solução de alginato contendo a enzima em uma solução contendo íons cálcio (Ca2+). Se ficou curioso a respeito desta técnica, você pode ver esse vídeo.
* Microencapsulamento: consiste na imobilização de enzimas em microcápsulas. É uma técnica versátil, porque é possível incluir mais de uma enzima no mesmo sistema. Um exemplo é a imobilização utilizando lipossomos, os quais contêm um centro aquoso e uma parte externa lipídica. Por ter essa característica lipofílica, pode proteger a enzima contra inibidores enzimáticos.
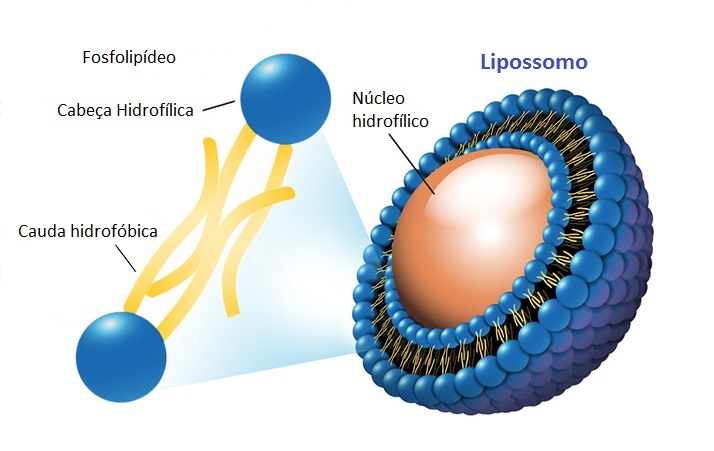
Representação de um Lipossomo. Adaptado de Benefits of lipossomal nutrients (liposomes).
Dentre as técnicas de formação de ligação temos:
* Adsorção: interação entre a enzima e o suporte por ligações fracas. Neste caso, as ligações químicas entre os componentes são do tipo van der Waals, ligações de hidrogênio, forças eletrostáticas e forças hidrofóbicas. Essa é uma das técnicas mais simples e mais fáceis, sendo a primeira empregada, historicamente, para a imobilização da enzima invertase em carvão ativo, em 1916.

Representação da enzima (em azul) imobilizada em um suporte (caixa transparente).
* Ligação Covalente: interação entre a enzima e o suporte por ligações covalentes. Como a ligação formada é forte, a enzima imobilizada obtida por este método é estável, isto é, não é liberada do suporte em presença do substrato ou de soluções de alta concentração iônica.
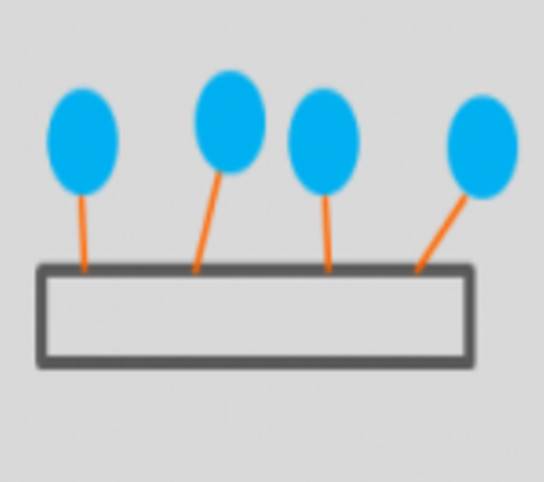
Representação da enzima (em azul) imobilizada em um suporte (caixa transparente) através de ligações covalentes (em laranja).
* Ligações Cruzadas: são covalentemente ligadas umas às outras utilizando reagentes como o glutaraldeído, por exemplo, que formará ligações cruzadas com a enzima, tornando-a insolúvel no meio reacional. Não há a necessidade de utilizar um suporte. Esta insolubilidade favorece sua recuperação ao término da catálise.
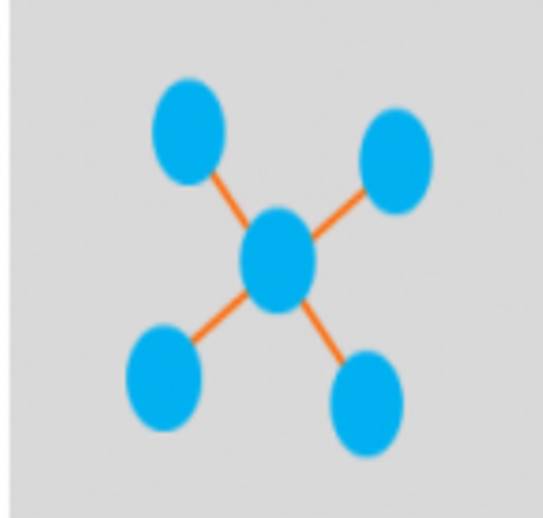
Representação da ligação cruzadas (laranja) entre as enzimas (azul) ligadas entre si com o auxílio do reagente glutaraldeído.
Suportes
Os suportes devem apresentar algumas características fundamentais para o sucesso da imobilização, dentre elas, ser: inertes (não reagir com a enzima), mecânica e quimicamente estáveis, de custo baixo, regeneráveis (poder regenerar para uma nova imobilização), resistentes ao ataque microbiológico, conter grupos químicos que podem ser ativados ou modificados (principalmente para a imobilização por ligação covalente, que pode requerer a mudança da superfície do suporte) e altamente poroso.
Exemplos de suportes utilizados para imobilização de enzimas

Vantagens e Desvantagens da Imobilização de Enzimas
Como vantagens, temos que a imobilização de enzimas promove o aumento e a manutenção da estabilidade das mesmas, facilita a remoção do biocatalisador do meio reacional para seu reuso, já que a proteína está insolúvel, pode promover a alteração das propriedades catalíticas da enzima de forma a aumentar a eficiência de catálise e pode diminuir os custos, desde que seu reuso compense os gastos com a imobilização.
Vale a pena mencionar que o aumento dos custos pode ser uma desvantagem para o processo de imobilização, além da possível diminuição da eficiência catalítica ou até mesmo a inativação da enzima, em função da presença do suporte. A necessidade de grandes quantidades da enzima purificada também pode ser considerada um desvantagem.
Até o momento, há no mercado poucas enzimas imobilizadas, principalmente em função dos elevados custos de imobilização. Contudo, quando se obtém sucesso neste processo, este torna-se bastante vantajoso. Por isso, é necessário aprofundar as pesquisas nesta área.
Aplicações
As enzimas imobilizadas apresentam uma série de propriedades especiais, que tornam suas aplicações mais promissoras em relação às enzimas solúveis. Dentre as aplicações de enzimas imobilizadas em escala industrial, podemos citar a produção de L-aminoácidos para aumentar o valor nutricional dos alimentos, produção de antibióticos e de biodiesel, tratamento de efluentes, dentre outras.
Os sistemas de enzimas imobilizadas são também empregados em diagnóstico, pois são utilizados na confecção de biossensores. A imobilização da glicose oxidase, para dosar a glicemia de pacientes diabéticos, é amplamente utilizada.
Considerações Finais
A imobilização de enzimas trata-se de uma técnica bastante promissora e precisa ser mais estudada, tanto no que diz respeito à produção de enzimas com maior eficiência catalítica, bem como em novos suportes e novas técnicas de imobilização, para assim produzir enzimas imobilizadas mais economicamente viáveis e com os mais diversos usos. Parece que temos bastante trabalho pela frente, não é mesmo?

Referências
CASTRO, H.F., ZANIN, G.M., MORAES, F.F., SÁ-PEREIRA, P. Imobilização de Enzimas e sua Estabilização. In: BON, E. P. S.; FERRARA, M. A.; CORVO, M. L. Enzimas em biotecnologia: produção, aplicações e mercado. Rio de Janeiro: Editora Interciência, 2008. cap. 6, p. 123-151.
VITOLO, M. Enzimas: as proteínas catalisadoras. In: VITOLO, M.; PESSOA JR., A.; SOUZA, G. M.; CARVALHO, J.C.M.; STEPHANO, M.A.; SATO, S. Biotecnologia Farmacêutica: Aspectos sobre aplicação industrial. São Paulo: Editora Blucher, 2015. Cap. 5, p.203-228.