Células-tronco podem ser definidas como células com capacidade de autorrenovação e diferenciação nos mais diversos tipos celulares. Desde sua descoberta, elas têm sido importantes para estudos básicos de funcionamento e desenvolvimento dos organismos. Além disso, possuem um grande potencial para terapia de doenças humanas. Muitos estudos têm sido realizados para o tratamento do câncer, doença de Alzheimer, infarto do miocárdio e muitas outras. Esse tratamento seria através da terapia celular, substituindo células doentes por células saudáveis.

Figura 1 – Potenciais usos das células-tronco em terapias (Fonte: Wikipedia)
Até 2006, células-tronco podiam ser obtidas de duas maneiras. A primeira forma é através da obtenção das células-tronco embrionárias. Contudo uma grande discussão ética sobre a utilização de embriões para obtenção dessas células ocorre mundialmente e acaba impedindo e desacelerando estas pesquisas. A segunda maneira é através da obtenção de células-tronco adultas dos mais diferentes tecidos, principalmente cordão umbilical e medula óssea. No entanto, o transplante de células de um paciente para outro pode levar a problemas de histocompatibilidade do sistema imune. Assim, uma nova técnica surgiu que permite gerar células-tronco pluripotentes a partir de um tecido totalmente diferenciado, como células da pele. Até esta data isso parecia algo impossível biologicamente, mas a sua descoberta acabou com os dois problemas citados.

Figura 2 – Fases do desenvolvimento embrionário onde se pode obter células-tronco. Fonte: IPCT
Essa descoberta possui três pilares: clonagem celular, fatores de transcrição e capacidade de cultivo celular. Em 1962, Gurdon inseriu o núcleo de células intestinais de rãs adultas em ovos não fertilizados e conseguiu gerar girinos. Em 1997, o caso mais famoso, a ovelha Dolly foi gerada pela inserção do núcleo de células da glândula mamária em óvulos anucleados, gerando assim o primeiro clone de um animal vertebrado no mundo. Isso demonstrou que as células totalmente diferenciadas continham material genético suficiente e necessário para a geração de um organismo completo, o que significa que elas não perdem informação ao longo do processo de diferenciação.

Figura 3 – Pilares fundamentais para a descoberta das iPSCs. (Yamanaka, 2012)
O segundo pilar foi a descoberta dos fatores de transcrição no processo de diferenciação. Em 1987 um estudo demonstrou que a expressão de um único fator de transcrição em Drosophila melanogaster (mosca da fruta), em uma região onde as antenas deveriam ser formadas gerou duas patas. Isso mostrou que os fatores de transcrição atuam como reguladores mestres, sendo o gatilho de uma cascata de sinalização envolvendo dezenas de genes que vão levar a formação de um membro tão complexo quanto as patas. Além disso, esses fatores de transcrição são conservados evolutivamente em todos os organismos, incluindo nos humanos.

Figura 4 –Experimento utilizando Drosophila melanogaster mutantes mostrando a importância de fatores de transcrição no processo de diferenciação. Fonte: http://faculty.pnc.edu/pwilkin/homeobox.html
E o terceiro, e último pilar, é a capacidade de cultivo celular e manutenção do estado indiferenciado das células. Manter essas células em cultivo de uma maneira a se manter a pluripotência destas por muito tempo foi um grande desafio. Porém, com os avanços dos métodos desde 1981, com o primeiro cultivo de células-tronco embrionárias, o problema foi superado.
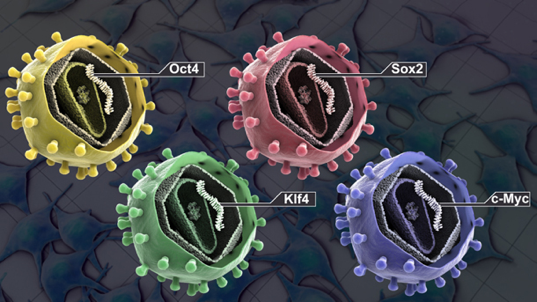
Tendo esses três pontos como base, Yamanaka e colaboradores, em 2006 em ratos, e 2007 em humanos, publicaram dois artigos mostrando a capacidade de transformar fibroblastos em células tronco pluripotentes. Isso foi realizado através da inserção por transdução viral de 4 fatores de transcrição: Oct4, Sox2, c-Myc e Klf4. Estes fatores ficaram conhecidos como fatores de Yamanaka. Estas células foram então chamadas de células pluripotentes induzidas (iPSCs). Após isso, diferenciaram as iPSCs em todos os três folhetos embrionários. Esse processo de desdiferenciação e diferenciação em um novo tecido ficou então conhecido como reprogramação celular.
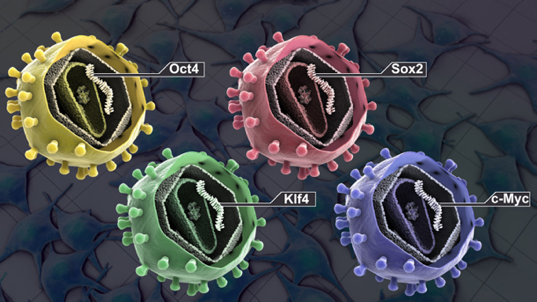
Figura 5 – Os 4 fatores de Yamanaka. Fonte: http://www.stemcellschool.org/
Com isso, surgiu a possibilidade de terapia celular utilizando iPSC que acabariam resolvendo os dois principais problemas até então encontrados para a utilização de células-tronco. Embriões não seriam mais necessários e, utilizando fibroblastos do próprio paciente, não haveriam problemas de histocompatibilidade.

Figura 6 – Terapia celular utilizando iPSCs. Fonte: IPCT
Em 2012, Shinya Yamanaka ganhou o Prêmio Nobel de Fisiologia ou Medicina. Atualmente, 10 anos desde a descoberta de Yamanaka, muito se avançou na ciência, e hoje estas células nos abrem horizontes para a terapia celular, produção de modelos de doenças e descoberta de novas drogas para terapia. Já sabemos que é possível reprogramar as células com outros fatores, não apenas os 4 fatores de Yamanaka, com muitos artigos publicados mostrando diferentes tipos de protocolos. A reprogramação que inicialmente era realizada por inserção viral, que poderia acarretar em disfunção de algum gene, hoje já é realizada com vetores epissomais não integrativos. Além disso, já temos capacidade de reprogramação in vivo, ou seja, dentro do próprio animal, sem necessidade de cultivo celular.

Figura 7 – Esquema demonstrando os processos de reprogramação in vitro (A) e in vivo (B). Fonte: Qian et al., 2012
Há também um grande potencial biotecnológico nessa descoberta, empresas brasileiras de Biotecnologia, como a Pluricell, já produzem cardiomiócitos humanos e oferecem serviços de reprogramação para laboratórios de pesquisa. Essa técnica é considerada por muitos o futuro da medicina regenerativa e os pacientes recebem de braços abertos todas as descobertas advindas da Biotecnologia.

Referências:
Kazutoshi Takahashi, Shinya Yamanaka. Induction of Pluripotent Stem Cells from Mouse Embryonic and Adult Fibroblast Cultures by Defined Factors. Cell 126 (4), 663–676, 2006.
Kazutoshi Takahashi, Koji Tanabe, Mari Ohnuki, Megumi Narita, Tomoko Ichisaka, Kiichiro Tomoda, Shinya Yamanaka. Induction of Pluripotent Stem Cells from Adult Human Fibroblasts by Defined Factors. Cell 131(5), 861–872, 2007.
Li Qian, Yu Huang, C. Ian Spencer, Amy Foley, Vasanth Vedantham, Lei Liu, Simon J. Conway, Ji-dong Fu & Deepak Srivastava. In vivo reprogramming of murine cardiac fibroblasts into induced cardiomyocytes.Nature 485, 593–598, 2012.
Shinya Yamanaka. Induced Pluripotent Stem Cells: Past, Present, and Future. Cell 10 (6), 678–684, 2012.
A Decade of iPS Cells (http://www.cell.com/ipsc)
http://www.pluricellbiotech.com.br/pt/prevendo-danos-no-coracao/
https://www.youtube.com/watch?v=Q9-4SMGiKnE
http://celulastroncors.org.br/celulas-tronco-2/
http://faculty.pnc.edu/pwilkin/homeobox.html
http://www.stemcellschool.org/
http://www.cienciahoje.org.br/noticia/v/ler/id/1074/n/mais_perto_das_terapias_celulares/Post_page/8
https://www.nobelprize.org/nobel_prizes/medicine/laureates/2012/yamanaka-facts.html