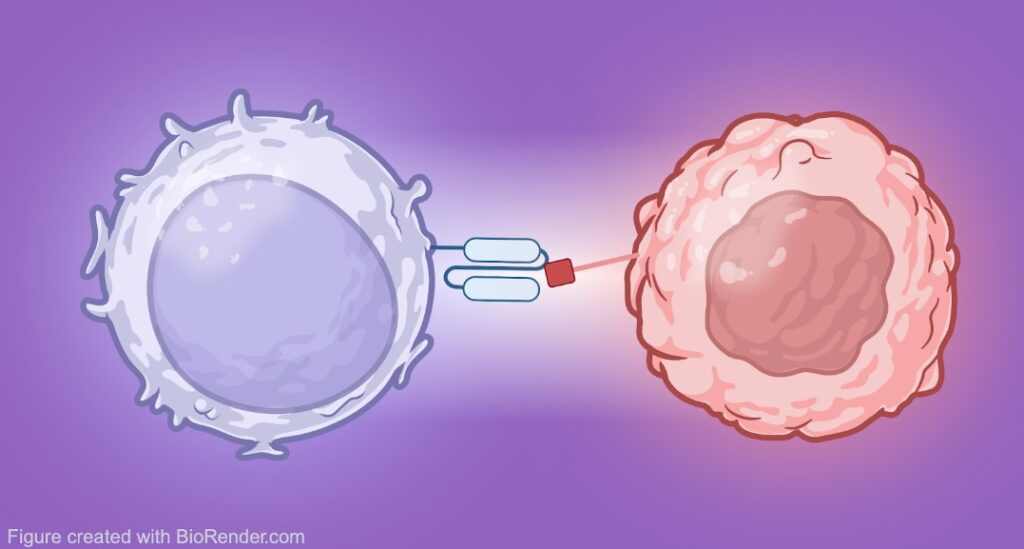
A medicina personalizada apresenta um potencial enorme no tratamento de diversas doenças. Entre as possibilidades de tratamentos personalizados encontra-se a terapia com as células CAR T, cujo potencial já foi apresentado no Profissão Biotec e atualmente existem 6 terapias à base de células CAR T aprovadas pelo FDA. Agora vamos explorar um pouco mais a parte molecular por trás deste tratamento e como os CAR se relacionam aos anticorpos.
A palavra CAR vem do inglês chimeric antigen receptor, o que significa receptor de antígeno quimérico. As células T podem ser engenheiradas para apresentarem o receptor CAR na superfície (daí o termo células CAR T) e, desta forma, elas são capazes de redirecionar a especificidade dessas células T. Agora você deve estar se perguntando, mas no que consiste o CAR e por quê quimérico, não? Apesar de inicialmente parecer estranho, antes de conseguirmos responder a essas perguntas, vamos primeiro entender a estrutura dos anticorpos.
Anticorpos ou imunoglobulinas
Anticorpos, também conhecidos como imunoglobulinas, são moléculas naturalmente produzidas pelas células B do sistema imune. Eles são glicoproteínas que reconhecem e se ligam com grande especificidade aos antígenos (“partículas estranhas ao corpo”), de forma a neutralizá-los e sinalizar para outras células do sistema imune que “têm algo errado ali”.
Molecularmente falando, os anticorpos podem ser subdivididos em diferentes classes chamadas de isotipos. Nos mamíferos são encontrados cinco principais isotipos: IgG, IgM, IgA, IgD e IgE. Aqui vamos nos referir aos anticorpos do isotipo IgG que é um dos mais comuns. Eles são compostos por duas cadeias polipeptídicas pesadas iguais (contendo mais aminoácidos) e duas cadeias leves (mais curtas) também iguais. As cadeias pesadas se associam por pontes dissulfeto e cada cadeia leve é conectada a uma cadeia pesada pelo mesmo tipo de ligação. Assim, o anticorpo apresenta um formato parecido com a letra “Y”. Para exemplificar, vamos observar a imagem de um anticorpo IgG e suas regiões a seguir.
Estrutura de um anticorpo IgG: as cadeias leves estão representadas em tons de verde e as pesadas de azul. O fragmento de ligação ao antígeno (Fab) está circundado em roxo. A parte do Fab responsável pelo reconhecimento do antígeno está circundado em laranja. O fragmento cristalizável (Fc) está circundado em rosa. Fonte: figura criada com BioRender.com pela autora. #ParaTodosVerem: o título da imagem “ Estrutura de um anticorpo IgG” está centralizado acima da imagem. Segue-se uma imagem de um anticorpo IgG em tons de azul e verde. O azul representa as partes da cadeia pesada do anticorpo, enquanto o verde representa as cadeias leves. Também é possível observar representações esquemáticas de duas pontes dissulfeto em azul entre as cadeias pesadas do anticorpo e uma ponte dissulfeto entre cada cadeia leve e as cadeias pesadas.
Na imagem observamos que a região formada pela junção de parte de uma cadeia pesada (azul) com uma cadeia leve (verde) dá origem ao fragmento de ligação ao antígeno, do inglês, fragment antigen binding ou Fab. O Fab, por sua vez, possui uma região mais constante e uma altamente variável e que, de fato, é responsável pela especificidade ao antígeno (circundada em laranja). Em contrapartida, a região do fragmento cristalizável, crystallizable fragment ou Fc é responsável por sinalizar quais funções biológicas “devem ser iniciadas” por outras células e moléculas.
Como vimos, apenas uma pequena parte do anticorpo é responsável pela identificação e ligação aos antígenos. Se essas pequenas partes da cadeia leve e pesada são recombinantemente expressas associadas por um linker, elas dão origem à pequenas proteínas responsáveis pela identificação do antígeno que são chamadas de sequência única de fragmento variável, single-chain fragment variable ou scFv. E aqui começa a correlação com os receptores quiméricos de antígeno, os CAR. Esses CAR podem ser engenheirados “como legos”, a parte externa com grande afinidade ao antígeno é geralmente um scFv.
As primeiras gerações de CARs
O design dos CAR evoluiu durante as últimas três décadas (e continua sendo aprimorado). A primeira geração de CARs trazia como parte extracelular a região responsável pelo reconhecimento e ligação ao antígeno (como vimos, tradicionalmente um scFv), a região transmembrana que ancora o CAR na membrana celular, e o domínio intracelular, um co-receptor de células T chamado CD3ζ, responsável pela função efetora. As gerações seguintes tiveram como alteração principal os domínios intracelulares, passando a incorporar co-estimuladores e outras moléculas visando melhorar a eficácia do tratamento, ou seja, maior proliferação das células CAR T no corpo e maior citotoxicidade direcionada às células tumorais. Para ficar mais claro, na imagem a seguir podemos ver como os três primeiros designs de CAR evoluíram de nenhum co-estimulador, para 2 co-estimuladores.
Representação simplificada das três primeiras gerações de CARs, sendo a principal diferença entre essas gerações relacionadas a incorporação de domínios co-estimulatórios no design. Fonte: figura criada com BioRender.com pela autora. #ParaTodosVerem: Acima encontra-se o título da imagem “primeiras gerações de CAR”. Abaixo é possível observar a representação simplificada das três primeiras gerações de CAR. Presente em todas as três gerações está o scFv representado em roxo e o domínio transmembrana em cinza. Logo abaixo, a primeira geração de CAR apresenta um domínio intracelular CD3ζ colorido em azul turquesa, a segunda geração apresenta um domínio co-estimulador laranja seguido do CD3ζ e a terceira geração apresenta dois domínios co-estimuladores seguidos do CD3ζ.
Em resumo, como vimos, os CAR visam o redirecionamento da reatividade das células T. Sendo assim, espera-se que as células do próprio paciente (após serem engenheiradas com o CAR) reconheçam e se liguem às células anômalas através do scFv (estrutura derivada de anticorpos), transmitindo o sinal para as partes internas do CAR que são então ativadas.
A terapia com CAR T é muito promissora especialmente para malignidades hematológicas, como a leucemia linfoblástica refratária aguda, onde uma remissão completa pôde ser observada em apenas 4 semanas em muitos pacientes. Porém, o tratamento de tumores sólidos ainda representa um grande desafio na área já que os ambientes tumorais são normalmente inibitórios e, não raramente, as células tumorais param de expressar o antígeno alvo. Aqui, novos designs de CAR podem contribuir com o avanço da área.
Além disso, outros tipos de células também podem se beneficiar dessa tecnologia, por exemplo, as células exterminadoras naturais, natural killer ou NK. Assim como as células T, as células NK também apresentam origem linfóide e são naturalmente responsáveis por eliminar células de câncer e/ou infectadas por vírus. Quando engenheiradas dão origem às células CAR NK, as quais também têm se destacado nos estudos pré-clínicos e clínicos por evitar a tempestade de citocinas.
O potencial das células CAR T é realmente incrível e o Brasil tem investido na pesquisa e desenvolvimento dos tratamentos com as células CAR T. Há expectativa de que no futuro o tratamento com as células CAR T venha a ser oferecido pelo Sistema Único de Saúde (SUS) e a um custo muito menor do que o atual. Além disso, existem pesquisas para ampliar a utilização das células CAR T para outras doenças, visando melhorar a qualidade de vida de diversos pacientes e oferecendo um tratamento de ponta (e possivelmente a cura) para muitos pacientes em fase avançada de doenças até então incuráveis.

Texto revisado por Bruna Cardias e Fabiano Abreu
Cite este artigo:
MELO, C. C. Você sabe qual a relação entre anticorpos e células CAR T? Revista Blog do Profissão Biotec, v. 11, 2024. Disponível em: <https://profissaobiotec.com.br/voce-sabe-qual-a-relacao-entre-anticorpos-e-celulas-car-t/>. Acesso em: dd/mm/aaaa.
Referências
ALBERTS, B., JOHNSON, A., LEWIS, J., et al. B Cells and Antibodies. In Molecular Biology of the Cell; Garland Science: New York, 2002.
AZIZ, M., IHEANACHO, F., HASHMI, M. F. Physiology, Antibody. Disponível em: https://www.ncbi.nlm.nih.gov/books/NBK546670/. Acesso em: 19 Ago.2024.
FARKONA, S., DIAMANDIS, E. P., BLASUTIG, I. M. Cancer Immunotherapy: The Beginning of the End of Cancer? BMC Med. v. 14, n. 1, 2016.
GONG, Y., WOLTERINK, R. G. J. K., WANG, J., et al. Chimeric antigen receptor natural killer (CAR‑NK) cell design and engineering for cancer therapy. J. Hematol Oncol. v.14, n. 73, 2021.
JANEWAY, C. A., TRAVERS, P., WALPORT, M., SHLOMCHIK, M. The Structure of a Typical Antibody Molecule. In Immunobiology: The Immune System in Health and Disease; New York: Garland Science, 2001.
JENSEN, M. C., RIDDELL, S. R. Designing Chimeric Antigen Receptors to Effectively and Safely Target Tumors. Curr. Opin. Immunol. v. 33, 2015.
NEELAPU, S. S., LOCKE, F. L., BARTLETT, N.L., et al. Axicabtagene Ciloleucel CAR T-Cell Therapy in Refractory Large B-Cell Lymphoma. N. Engl. J. Med. v. 377, n. 26, 2017.
SADELAIN, M., BRENTJENS, R., RIVIÈRE, I. The Basic Principles of Chimeric Antigen Receptor Design. Cancer Discov. v. 3, n. 4, 2013.
SCHROEDER, H.W., CAVACINI, L. Structure and Function of Immunoglobulins. J. Allergy Clin. Immunol. v. 125, n. 2, 2010.
STERNER, R. C., STERNER, R.M. CAR-T Cell Therapy: Current Limitations and Potential Strategies. Blood Cancer J. v. 11, n. 4, 2021.
TOKAREW, N., OGONEK, J., ENDRES, S., et al. Teaching an old dog new tricks: next-generation CAR T cells. Br. J. Cancer. v. 120, n. 1 ,2019.
WALDMAN, A.D., FRITZ, J. M., LENARDO, M. J. A Guide to Cancer Immunotherapy: From T Cell Basic Science to Clinical Practice. Nat. Rev. Immunol. v. 20, n. 11, 2020.
Fonte da imagem destacada: figura criada com BioRender.com pela autora.